1 引言
近年来, 随着社会经济的快速发展及人们对环境质量要求的不断提升, 地下 水污 染逐渐受到广泛关注.通过对中国东部平原地下水污染调查评价发现, 该区域地下水中“三氮”普遍呈面状污染特征, 重(类)金属呈点污染特征, 尤以铅、砷污染较严重, 有毒有害有机污染呈现“检出率高、超标率低”的特征, 其中有机污染物中挥发性有机污染物对地下水质量影响较大, 主要检出的污染物包括苯系物和氯代烃等.
作为地下水中主要存在的苯系物和氯代烃类污染物, 苯、甲苯、乙苯和二甲苯(BTEX)以及三氯乙烯(TCE)和四氯乙烯(PCE)开始受到广泛关注.对于地下水中氯代烃类污染物(TCE、PCE)的修复, 由于其难生物降解性而常通过零价铁渗透感应格栅(ZVI PRB)化学还原脱氯的方法, 将TCE、PCE逐级还原为二氯乙烯(DCE)和氯乙烯(VC), 并比较终还原为乙烯或乙烷, 但在此过程中也常伴随着地下水环境中pH的升.对于地下水中BTEX污染物的修复, 由于其易生物降解性而常通过生物降解格栅的方法将BTEX比较终降解为CO2, 并伴随有儿茶酚、苯甲酸等中间产物的生成.

然而, 地下水污染中常常是几种不同类型的污染物同时存在于地下水中并构成不同类型的污染羽, 如由氯代烃和BTEX构成的混合污染羽.将零价铁渗透反应格栅和生物降解格栅联用, 利用氯代烃的易还原脱氯的性质先通过零价铁渗透反应格栅去除氯代烃, 后利用BTEX易生物降解的性质通过生物降解格栅去除BTEX, 可以有效去除由这两种性质迥异的污染物形成的混合污染羽.但是, 在联合零价铁渗透反应格栅-生物降解格栅运行过程中, 零价铁渗透反应格栅后的强碱性pH环境(pH>9)、氯代烃脱氯还原中间产物(cis-1, 2-DCE)的积累和可能出现的TCE穿透均可能对生物降解格栅中BTEX的生物降解产生影响.针对上述问题, 本文以苯或甲苯为研究对象, 采用批试验方法, 以粒状铁化学还原TCE后的出水环境为基础, 从长期受石油原油污染的土壤中分离和培养降解苯或甲苯的微生物, 研究不同pH条件下TCE和cis-1, 2-DCE对苯或甲苯厌氧生物降解的影响.
2 材料与方法
2.1 地下水和石油污染土壤
实验用地下水取自中国地质大学(北京)自备井, 其中K+、Na+、Ca2+、Mg2+、Fe3+、Cl-、NO3-和SO42-的浓度分别为1.92、18.01、73.96、33.3、0.21、47.29、9.12和69.78 mg·L-1.地下水使用前用N2曝气至溶解氧(DO)<1.0 mg·L-1后加入粒状铁密封备用, 经常摇动.本文中如未特别说明, 地下水均指此类.
石油污染土壤取自辽宁某油田包气带土壤(有机碳含量为48.53 g·kg-1, 碳氮比为112.3), 用于实验过程中苯或甲苯生物降解菌的培养.
2.2 主要仪器和试剂
Agilent 6890N/5975气相色谱-质谱仪;HP-5 MS毛细管色谱柱(30 m×0. 25 mm×0.25μm, 美国安捷伦公司);G1888型顶空自动进样器(美国安捷伦公司).PB-10型精密pH计(德国赛多利斯公司).HQ-30d型溶解氧测定仪(美国哈希公司).SPX-250型智能生化培养箱(宁波海曙试验仪器厂).
苯、甲苯、三氯乙烯(TCE)、叠氮钠(NaN3)、氢氧化钠(NaOH), 分析纯, 购于北京化学试剂公司, 用地下水配制成一定浓度溶液备用.顺式1, 2-二氯乙烯(cis-1, 2-DCE)溶液的制备:在4 L棕色瓶中加入500 g粒状铁, 加地下水至近满, 加入一定浓度TCE, 用橡胶塞和封口膜密封, 定期测试cis-1, ?2-DCE?浓度备用.高纯N2、He:99.999%(北京普莱克斯实用气体有限公司).
2.3 微生物的培养和驯化
在2个500 mL广口瓶(培养瓶)中加入300 g石油污染土壤, 注入地下水至近满后, 吹N2 1 h(保证培养瓶中DO < 1.0 mg·L-1)用橡胶塞密封.在避光、23℃培养箱中培养5~7 d后, 分别取300 mL上层清液至2个1 L具聚四氟乙烯内垫螺旋盖棕色瓶(驯化瓶)中, 吹N2 1 h后(保证驯化瓶中DO < 1.0 mg·L-1)分别加入约200μg·L-1的苯或甲苯.在避光、23℃培养箱中培养5~7 d后, 转移出约500 mL的菌液并补充入新鲜地下水, 吹N2 1 h后(保证驯化瓶中DO < 1.0 mg·L-1)再分别加入约500μg·L-1的苯或甲苯.此后, 照此方法分别逐步提高苯或甲苯的浓度至4 mg·L-1, 以培养和驯化可以厌氧生物降解苯或甲苯的微生物.在培养驯化过程中, 加入只有苯或甲苯的挥发控制样.
2.4 TCE和cis-1, 2-dichloroethene对苯或甲苯厌氧生物降解的影响2.4.1 pH=7.9时TCE和cis-1, 2-dichloroethene对苯或甲苯厌氧生物降解的影响
(1)苯
待苯厌氧生物降解菌液驯化好后, 从同批次驯化瓶中转移300 mL菌液至1 L具聚四氟乙烯内垫螺旋盖棕色瓶(试验瓶)中并补充入新鲜地下水, 吹N2 1 h后(保证驯化瓶中DO < 1.0 mg·L-1)加入苯, 并分别加入约100μg·L-1的cis-1, 2-DCE和100、500μg·L-1的TCE, 进行cis-1, 2-DCE和TCE对苯厌氧生物降解的影响实验.实验过程中, 加入只有苯、甲苯、TCE和cis-1, 2-DCE的挥发控制, 所有实验均设计1个平行样, 且试验误差 < 10%, 后续“结果与讨论”图中不再标注误差线.
(2)甲苯
待甲苯厌氧生物降解菌液驯化好后, 按照上述苯实验步骤继续进行实验.
2.4.2 pH=10.5时TCE和cis-1, 2-dichloroethene对苯或甲苯厌氧生物降解的影响
另取苯或甲苯厌氧生物降解菌液, 用NaOH溶液调节初始pH为10.5, 按照1.4.1节所述方法再进行实验.
2.5 分析方法
苯、甲苯cis-1, 2-DCE和TCE采用顶空-气相色谱-质谱法测定.顶空瓶区温度85℃, 定量环loop温度95℃;传输线温度150℃;进样时间1. 00 min.气相色谱进样口温度150℃;分流进样, 分流比1∶1;升温程序:初始40℃保持5 min, 以10℃·min-1升至200℃保持3 min.数据采集为选择离子监测(SIM)方式.外标法定量.苯和甲苯校准曲线范围:0.1~5 mg·L-1, 检出限:1μg·L-1.cis-1, 2-DCE和TCE校准曲线范围:10~1000μg·L-1, 检出限:10μg·L-1.
样品制备:在10 mL顶空瓶中预先加入10 g·L-1的NaN3溶液1.0 mL, 取样4.0 mL于顶空瓶中, 压盖密封后及时分析.不能及时分析的样品于4℃保存.
2.6 苯或甲苯厌氧生物降解半衰期和滞后系数的计算
Mehrdad等(2008)报道称BTEX的生物降解符合准一级降解动力学方程(式(1)), 因此可通过式(2)计算苯或甲苯厌氧生物降解半衰期:
(1)
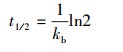
(2)
式中, C为苯或甲苯的浓度, t为降解时间, kb为苯或甲苯生物降解速率常数;t1/2为苯或甲苯生物降解半衰期.
在本文中, 为表示cis-1, 2-DCE和TCE对苯或甲苯厌氧生物降解影响的强弱, 按式(3)所示计算cis-1, 2-DCE和TCE对苯或甲苯厌氧生物降解半衰期的滞后系数(IC).
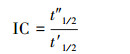
(3)
式中, t′1/2为无cis-1, 2-DCE和TCE时苯或甲苯的生物降解半衰期, t″1/2为有cis-1, 2-DCE和TCE时苯或甲苯的生物降解半衰期.当IC>1时, 表示cis-1, ?2-DCE?和TCE的存在会抑制苯或甲苯的生物降解;当IC < 1时, 表示cis-1, 2-DCE和TCE的存在有利于苯或甲苯的生物降解.
3 结果与讨论
3.1 不同pH条件下TCE和cis-1, 2-dichloroethene对苯厌氧生物降解的影响
实验过程中, 假设运行过程中零价铁渗透反应格栅后TCE的穿透浓度为100和500μg·L-1, 研究TCE对苯或甲苯厌氧生物降解的影响.对于cis-1, ?2-DCE?对苯或甲苯的影响, 由于在我国地下水环境质量标准(GB/T 14848—1993)中尚无对cis-1, ?2-DCE?的要求, 但在地表水环境质量标准(GB 3838—2002)中规定地表水中cis-1, 2-DCE的浓度不能超过50μg·L-1, 且零价铁渗透反应格栅后cis-1, 2-DCE的浓度也均未超过50μg·L-1.因此, 本实验中cis-1, ?2-DCE?的浓度设定为100μg·L-1.
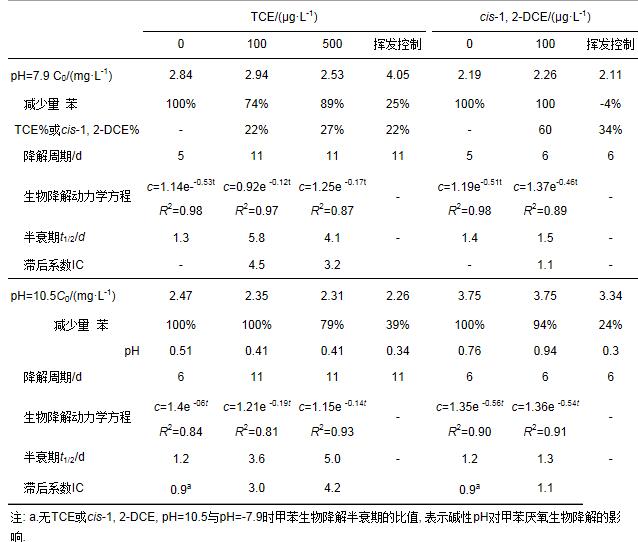
不同pH条件下(pH=7.9和10.5), TCE和cis-1, 2-DCE对苯厌氧生物降解的影响如图 1和表 1所示.未加入TCE和cis-1, 2-DCE时, 当pH由7.9增加至10.5时, pH对苯生物降解的滞后系数(IC)为0.9, 这说明碱性pH有利于苯的厌氧生物降解.这是由于苯的厌氧生物降解过程是一个产酸过程, 碱性pH更有利于其降解中间产物和终产物的转化, 进而促进生物降解.不同pH条件下加入TCE或cis-1, ?2-DCE?后, 微生物对苯的生物降解效率均受到不同程度的抑制.在pH=7.9时, TCE 100和500μg·L-1对苯生物降解的滞后系数(IC)分别为4.5和3.2, 而当pH升高至10.5时, 这一数值分别为3.0和4.2.在pH=7.9和pH=10.5时, cis-1, 2-DCE 100μg·L-1对苯生物降解的滞后系数(IC)均为1.1.由此说明, TCE和cis-1, 2-DCE均会对苯的生物降解产生抑制作用, 但是TCE的抑制作用要强于cis-1, 2-DCE, 且浓度>100μg·L-1的TCE对苯生物降解的抑制没有明显差异.
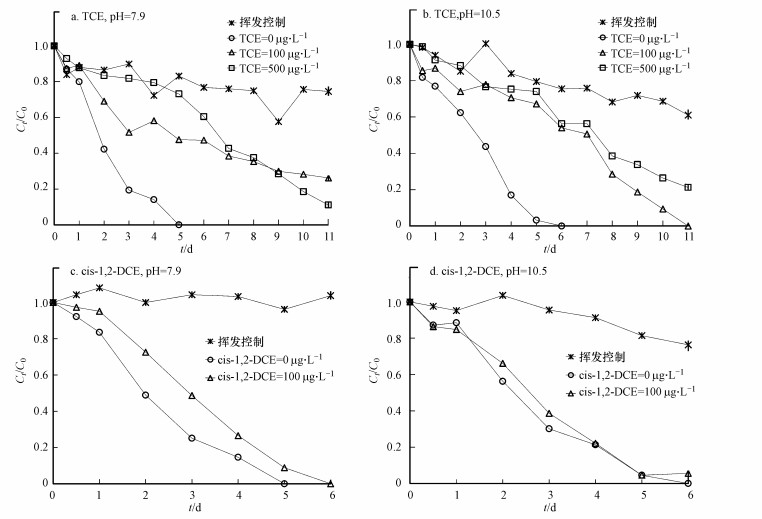
图 1同pH条件下TCE和cis-1, 2-DCE对苯厌氧生物降解的影响(所有实验均设计1个平行样, 且试验误差 < 10%)
表 1 pH 7.9或10.5时TCE和cis-1, 2-DCE对苯厌氧生物降解的影响
3.2 不同pH条件下TCE和cis-1, 2-dichloroethene对甲苯厌氧生物降解的影响
不同pH条件下(pH=7.9和10.5), TCE和cis-1, 2-DCE对甲苯厌氧生物降解的影响如图 2和表 2所示.未加入TCE和cis-1, 2-DCE时, 当pH由7.9增加至10.5时, pH对甲苯生物降解的滞后系数(IC)为0.2~0.5, 这说明碱性pH同样有利于甲苯的厌氧生物降解.这是由于甲苯的厌氧生物降解过程与苯一致, 都是一个产酸过程, 碱性pH更有利于其降解中间产物和终产物的转化, 进而促进生物降解.
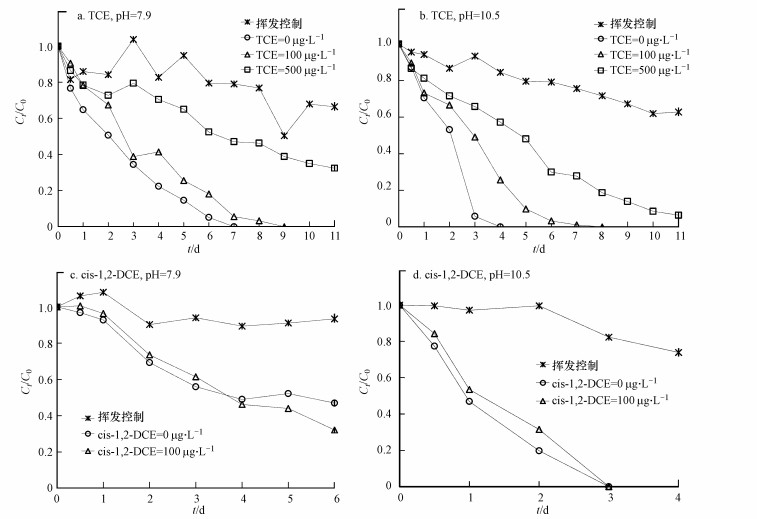
图 2不同pH条件下TCE和cis-1, 2-DCE对甲苯厌氧生物降解的影响(所有实验均设计1个平行样, 且试验误差 < 10%)
表 2 pH 7.9或10.5时TCE和cis-1, 2-DCE对甲苯厌氧生物降解的影响
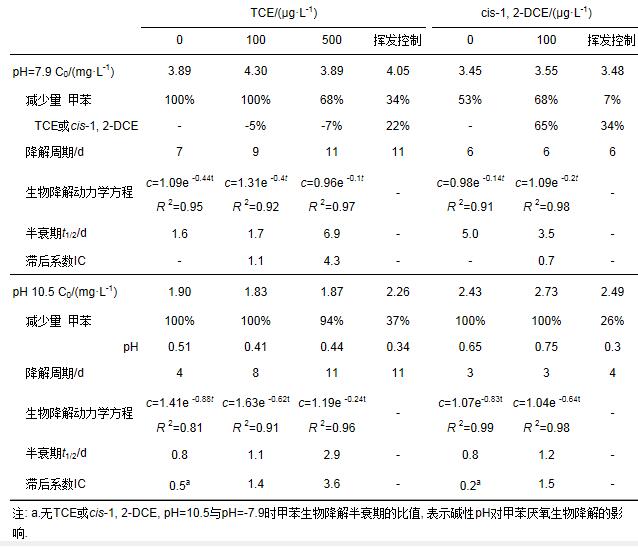
在pH=7.9时, TCE 100和500μg·L-1对甲苯生物降解的滞后系数(IC)分别为1.1和4.3, 当pH升高至10.5时, 这一数值分别为1.4和3.6, 而cis-1, 2-DCE 100μg·L-1对甲苯生物降解的滞后系数(IC)在pH=7.9和pH=10.5时分别为0.7和1.5.由此说明, 不同pH环境下TCE均会对甲苯的生物降解产生抑制作用, 且抑制作用随着TCE浓度的增加而增加.然而, pH=7.9时cis-1, 2-DCE的加入却有利于甲苯的生物降解, 但随着pH的增加又转变为抑制, 且cis-1, 2-DCE的抑制作用同样始终弱于TCE.
从降解前后TCE和cis-1, 2-DCE的浓度变化可以看出, 苯或甲苯降解前后反应瓶中TCE浓度的减少始终 < 27%, 而cis-1, 2-DCE浓度的减少却>60%(控制样中TCE和cis-1, 2-DCE的减少量分别为22%和34%).这说明在苯或甲苯厌氧生物降解过程中, 可能存在cis-1, 2-DCE与苯或甲苯的共代谢生物降解.而且, 从cis-1, 2-DCE对苯或甲苯不同的抑制作用来看, 甲苯更有利于cis-1, 2-DCE的共代谢降解.
4 结论
1)碱性pH有利于苯或甲苯的厌氧生物降解.
2)不同pH下, TCE或cis-1, 2-DCE均会对苯或甲苯的厌氧生物降解产生抑制作用(除pH=7.9, cis-1, 2-DCE=100μg·L-1时的甲苯), 且cis-1, 2-DCE的抑制作用始终弱于TCE.
3)TCE为100和500μg·L-1对苯厌氧生物降解作用的抑制效果没有明显差异, 而TCE对甲苯厌氧生物降解的抑制作用却随着TCE浓度的增加而增加.
4)pH=7.9时, cis-1, 2-DCE的加入有利于甲苯的厌氧生物降解, 但随着pH的增加又转变为抑制.
5)在苯或甲苯厌氧生物降解过程中, 可能存在cis-1, 2-DCE与苯或甲苯的共代谢生物降解, 且甲苯更有利于cis-1, 2-DCE的共代谢降解.





